中草药肝损伤的临床诊断
Clinical diagnosis of Chinese-herbal-induced liver injury
引用本文:于乐成,郝坤艳,范晔. 中草药肝损伤的临床诊断[J]. 中国药物警戒. 2023, 20(5): 481-488.
Reference: YU Lecheng, HAO Kunyan, FAN Ye. Clinical diagnosis of Chinese-herbal-induced liver injury[J]. Chinese Journal of Pharmacovigilance(中国药物警戒). 2023, 20(5): 481-488.
专家介绍

于乐成,主任医师、教授。东部战区总医院感染病科/肝病中心主任、主任医师,医学博士。中华医学会肝病学分会五至七届药物性肝病学组副组长,江苏省医学会肝病学分会副主任委员/药物与自免肝学组组长、感染病学分会常委。肝脏杂志共同主编,中华肝脏病杂志、临床肝胆病杂志等学术期刊编委。主持和参与科研课题近20项,编译或参编专著教材22部,发病论文160余篇。参编我国首部《药物性肝损伤诊治指南》等多部肝病指南或专家共识。
摘要:目的 为中草药肝损伤(HILI)的临床诊断提供基于模块化证据链的路线图。方法 分析中草药应用与肝损伤发生的时序关系、中草药自身相关肝毒性信息、合并用药情况的评估及非药物性肝损伤因素的排查等 4 大模块信息,并进行证据链的逻辑组合。结果及结论 HILI 的临床诊断原则与现代药(化学药和生物医药)相似,但具有自身的特点和难点。在阐述中草药与肝损伤时序关系多样性的基础上,对中草药相关肝毒性、合并用药肝毒性及其他肝损伤病因的存在情况进行了多维评估,构建了基于完整证据链的HILI 临床诊断路线图。罗素优克福因果关系评估法(RUCAM)量表对 HILI 的诊断有参考价值,改良电子化因果关系评估法(RECAM)量表对 HILI 的诊断价值有待在真实世界临床进一步论证,必要时可借助结构化专家观点程序(SEOP)确认诊断;肝活检病理组织学的某些病变特点有助于明确HILI 的诊断;HILI 相关生物标志物有待深入探索。
关键词:中草药;肝损伤;临床诊断;证据链;路线图
正文
中药(Chinese traditional medicine,TCM)药材种类来源广泛,涉及各种草药、动物源性成分、矿物质等,其中以中草药(Chinese herbal medicine)种类最多、应 用最广,引起的肝损伤(herb-induced liver injury, HILI)事件也最多,在药物性肝损伤(drug-inducedliver injury,DILI)的病因谱中占有较高的构成比 [1-2]。草药不仅包括处方或非处方的传统中草药,也包括通过现代科技手段从草药材中提取有效成分而制备的天然药(natural medicine,NM)[1]。HILI 影响因素众多,包括药物本身特性、配方组合、属地、运输 /储存 / 炮制过程中的污染及变质、不合理应用(特别是非处方用药及土方、偏方)、个体差异等。复方中草药成分多样,即使发生肝损伤,多数情况下也很难明确到底是由哪种药材或成分所致 [2-3]。当中草药说明书对药材成分和含量记录不详,其肝毒性在文献数据库中无报道,在 LiverTox 网站 [4] 和 HepaTox 网站 [5] 无记载,则 HILI 的诊断更具有挑战性。此外,许多中草药配方可能掺杂或与某些化学药物联合使用,很多患者有慢性肝病基础或有其他可影响肝脏的疾病,进一步增加了 HILI 的识别难度。因此,HILI 的精准诊断不仅需要遵循 DILI 临床诊断的基本逻辑,同时也要考虑到 HILI 自身的特殊性。首先要确认用药与肝损伤的时序关系,继而多维分析中草药自身的肝毒性相关信息,厘清合并用药情况,鉴别其他病因肝损伤的存在和活动情况,从而形成完整的证据链,构建严谨的 HILI 诊断路线图。
1
准确了解应用中草药与肝损伤的时序关系
临床诊断时,应详细询问患者在发生肝损伤之前有无应用中草药史。除了处方意义上的中药,也要特别注意各种情况的非处方用药。很多情况下,中草药被作为保健品或茶类等饮品看待,患者并不认为自己应用了中草药。因此,临床医师有时需要反复提醒患者才能获得准确的中草药应用信息。
中草药开始应用的时间先于急性肝损伤的发生是诊断 HILI 的先决条件。即使急性肝损伤发生在应用中草药之后,也需根据不同情况进行分析。这些逻辑考量在近 30 年常用的罗素优克福因果关系评估(rousse uclaf causality assessment method,RUCAM)量表 [6-7] 和新推出的“改良电子化因果关系评估(revised electronic causality assessment method,RECAM)量表”[8]中均有体现:①若急性肝损伤发生在应用中草药后2~90 d(特别是 5~30 d),则应高度怀疑中草药与肝损伤之间存在较大可能性的因果关联。②通常情况下,多数 HILI 不会在用药后不足 2 d 内发生,但若某种中草药单次剂量高、直接肝毒性大,则用药后不足2 d 内发生肝损伤也是可能的。③若急性肝损伤发生在应用中草药后 90 d 或以上,通常认为其与中草药的因果相关性降低,另一方面,由于某些药物(含中草药)在体内代谢较慢,或长期用药可能导致药物及其毒性代谢产物在体内(特别是肝脏内)逐渐蓄积,因此服用某些中草药有可能在 90 d 或更长时间之后(通常不超过 1 年)才出现肝损伤表现。因此,急性肝损伤不论是发生在应用中草药后不足 2 d内,还是在应用中草药 90 d 或更长时间之后,均不宜据此轻易肯定或否定 HILI 的诊断,而是需要根据具体情况谨慎判断。④考察停用中草药与肝损伤发生的时间关系,对于判断 HILI 也有一定的价值。一般认为,停用药物或草药后 30 d 内出现的急性肝损伤,可能与应用药物或草药相关;也有认为停药后 15 d内出现的急性肝细胞损伤,或停药 30 d 内出现的胆汁淤积性肝损伤,可能与应用药物或草药相关,超过这个时限,肝损伤由药物或草药引起的可能性不大 [6-8]。
若出现以下情况,中草药也可能引起慢性肝损伤。①中草药连续或长期不规则反复使用;②虽然中草药总疗程未必很长,但某些中草药引起的重金属等毒性物质在肝脏沉积时间较长、不易被及时清除;③某些中草药可能刺激机体产生自身免疫样反应,引起具有自身免疫特征的 HILI,难以在 6 个月内自行恢复正常。故一旦发现患者有服用中草药史,存在慢性肝损伤,则应仔细询问初期应用中草药后是否曾发生过急性肝损伤,是否在用药前已经排除基础性肝病。还需注意,慢性 HILI 可能在初期表现为急性病程、进而转为慢性病程,也可能呈隐匿性进展,仅在实验室和影像检查时发现存在慢性肝病。
需要注意的是,如果是在慢性活动性肝病的基础上叠加 HILI,则所谓肝脏生化指标异常很可能在服用中草药之前已存在,这种情况不能做为否定HILI 诊断的依据。此时需要仔细考察服用中草药之后相关时段内肝脏生化指标水平相对于服药前的基线值是否有明显升高。
多维考察能够反映中草药肝毒性的各类信息
2
了解中草药的种类、组方、剂量、疗程
应尽可能准确了解患者所用中草药的具体名称、组方、剂量、疗程(起止时间),这是进一步分析中草药与肝损伤之间是否存在因果关系的基础。如果组方中含有何首乌 [9]、雷公藤 [10]、土三七 [11]、补骨脂 [12]等有明确肝毒性文献报告的成分,将增加 HILI 诊断的可能性。通常剂量越大、疗程越长,出现 HILI 的风险也越高。对于复方中草药,要仔细了解相关配方信息,因为中医讲究辨证论治、君臣佐使、配伍禁忌、“十八反”“十九畏”等原则,违反这些原则可能导致 HILI 风险增加 [2]。
了解中草药既往肝毒性信息
如果中草药或其组方成分既往有引起肝毒性的各类文献记载,则将增加因果关系评估的分值。既往肝毒性的信息源越强,中草药与肝损伤之间的因果关联也越强。药物既往肝毒性信息可以通过药物说明书、中国知网和 PubMed 等文献数据库、LiverTox网站、HepTox 网站等进行查询;医生个人的临床经验和患者对既往用药反应的记述,也是重要参考信息。对药物既往肝毒性的评估等级,RUCAM 量表推荐主要参考药物说明书和文献数据库 [7],而 RECAM量表则建议参照 LiverTox 网站对肝毒性等级的划分标准 [8],建议应当收集各类既往肝毒性信息进行综合衡量。
草药中具有肝毒性风险的化学成分大致可分为10 大类,包括生物碱类、鞣质及其酚类、重金属类、糖及苷类、黄酮类、毒蛋白类、萜和挥发油类、苯丙素类、醌类、甾体及其苷类 [13]。土三七的化学成分包括生物碱、香豆素、皂苷类等;服用土三七可导致人体甘油磷脂、胆汁酸代谢紊乱,还可导致肝窦等肝血管内皮细胞的损伤 [14]。
炮制方法对药材的肝毒性也有重要影响。以何首乌的制作为例,通过将药材切成块状或者片状,然后放置在阳光下晒干这种炮制方法得到的称为“生首乌”,通过把何首乌生品放入黑豆汁搅拌蒸煮(或者其他不同于晒干的炮制方法)得到的称为“制首乌”。生首乌、制首乌提取物的肝毒性存在差异。有研究显示,两者均能引起一定程度的氧化应激和内质网应激反应,降低线粒体膜电位造成线粒体功能损伤,最终导致肝细胞凋亡;但两者引起应激反应的强弱,以及所需药物浓度和作用时间均有很大差别,生首乌提取物较制首乌提取物的肝毒性大 [15]。
中草药属地不同,其肝毒性大小也可能存在差异。如某医院报 道 2007 年 8 月至 2008 年 10 月 30例单服痔血胶囊(主要成分为白鲜皮和苦参)的患者发生肝损伤。鉴于以往许多患者服用痔血胶囊并未出现肝损伤,肝损伤病例主要发生在白鲜皮属地由内蒙古某地更换为安徽省某地之后,因此推测不同属地的白鲜皮其肝毒性风险不同 [16]。属地气候等自然环境的差异、土壤重金属污染、运输和储存不当等因素,均可能与不同属地中草药的肝毒性风险存在差异相关。
2.3
分析中草药使用过程中肝脏生化指标异常
的变化趋势
中草药持续使用过程中,如果出现明显的肝损伤且不能自行缓解,甚至进行性加重,则要高度警惕 HILI 的可能。如果出现血清丙氨酸氨基转移酶(ALT)和 / 或碱性磷酸酶(ALP)等肝脏生化指标一过性异常,可能属于人体对中草药的“适应性”反应,亦即人体的解毒系统能够迅速对中草药的这种毒性反应进行有效的拮抗和平衡,从而迅速自我缓解甚至完全恢复正常 [1,17]。
2.4
分析中草药停用后肝脏生化指标的变化趋势
停用中草药后血清肝脏生化指标的变化趋势对于判断中草药与肝损伤之间的因果关系十分重要,这在临床上被称为“去刺激(dechallenge)”反应或“去除药物(washout)”反应。如果停用中草药后,肝损伤迅速恢复,这种情况称之为“去刺激反应阳性”,是支持 HILI 诊断的重要证据 [6-8]。
反之,如果停药后肝损伤不能迅速缓解,甚至继续加重,这种情况称为“去刺激反应阴性”[6-8]。对去刺激反应阴性的意义解读应慎重,不能简单认为据此可以排除 HILI 的诊断。临床上至少要考虑以下 3 种可能:①中草药激发了体内的炎症瀑布反应,使得肝损伤在停用中草药后不能迅速恢复,或仍继续加重;②肝损伤是由其他有尚未查明的病因所致;③ HILI 和其他病因所致的肝损伤同时存在。
在没有使用抗炎保肝利胆药物情况下,停用中草药后肝脏生化指标的变化趋势是判断中草药与肝损伤因果关系的重要依据之一。但在真实世界中发现肝脏生化指标异常后,患者往往立即接受抗炎保肝利胆治疗,必然影响通过“去刺激反应”来判断中草药与肝损伤之间因果关系的价值。对于肝细胞损伤型 HILI,在已经应用抗炎保肝药物的情况下,通过观察门冬氨酸氨基转移酶(AST)而不是 ALT 的变化趋势,可能更有助于通过评估“去刺激反应”来推断药物与肝损伤的因果关系;这是因为某些药物降低 ALT 水平的效果十分明显,但对 AST 水平的影响相对不显著。但对于胆汁淤积型 HILI,并不能应用 γ- 谷氨酰转肽酶(GGT)来代替 ALP 进行“去刺激反应”的判断 [18]。
不论是否应用抗炎保肝利胆药物,基于血清肝胆酶谱水平等生化指标变化趋势的“去刺激反应”一般不适合下列情况下中草药与肝损伤因果关系的推断:①原先已经存在活动性慢性肝损伤;②肝窦阻塞综合征 / 肝小静脉闭塞病(HSOS/HVOD);③药物相关脂肪肝;④其他特殊表型的肝损伤。
2.5
调查中草药再次应用后的肝毒性发作情况
药物再刺激(rechallenge)的结果同时反映了药物因素和宿主因素对肝损伤发生的共同影响。以往认为,如果患者应用某种药物曾经发生肝损伤,那么再次应用该药后往往也会发生肝损伤(再刺激试验阳性),且肝损伤的发生往往潜伏期更短、肝损伤更严重 [18-20]。然而,大量临床实践提示,虽然确实存在这种现象,但由于患者基础疾病等体质状态、药物的批次和剂量疗程(例如脱敏疗法的采用)、糖皮质激素等合并用药因素的影响,以往曾发生过 DILI 或HILI 的患者,再次应用同种或同类药物未必出现再刺激反应阳性。此外,固有肝毒性药物、特异质性肝毒性药物和间接肝毒性药物,其再刺激反应出现的概率、潜伏期和强度也可能存在很大不同,这些都需要在未来进一步深入观察和研究。可见,再刺激反应阳性可以作为 HILI/DILI 临床诊断的“金标准”,但再刺激反应阴性并不能作为排除 HILI/DILI 的充分依据。
药物再刺激反应的方法及结果的判定,目前尚缺 乏 统一意 见。RUCAM 量 表 [6-7]、RECAM 量 表 [8]及药物临床试验各自提出了进行药物再刺激的方法和结果判定标准,但彼此之间存在较大差异,评估结果往往不一致,给临床和科研带来不少困扰,亟需达成相关共识 [20]。
3
详细了解合并用药的种类、肝毒性信息、潜在药物相互作用
应详细了解与中草药同时或先后应用、且与肝损伤具有时序相关性的药物使用情况。临床上,中草药和化学药物联合使用的情况非常多见,中草药制品中添加某些化学药成分也不少见。一方面某些化学药物本身可能存在肝损伤作用,如抗感染药物(包括抗结核药物)、抗肿瘤药物、非甾体解热镇痛药物、降脂药物、抗抑郁药物等;另一方面,中草药和化学药物进入体内后,相互间可能改变药物的吸收、分布、代谢、排泄和药理作用,产生药物间相互作用(DDI),从而增加 HILI 或 DILI 的发生风险 [1-2]。如抑制SARS-CoV-2 复制的药物 Paxlovid(奈玛特韦 / 利托那韦)与许多药物(包括某些中药草成分如圣约翰草等)均存在 DDI[21],这些情况使得 HILI 的诊断进一步具有不确定性,因此需要仔细进行鉴别诊断。
其他肝损伤病因的排查
4
排查是否存在其他肝损伤病因是 HILI 和 DILI因果关系判断必不可少的环节,排查范围包括各类病毒性肝炎、自身免疫性肝病(特别是自身免疫性肝炎)、非酒精性脂肪性肝病、酒精性肝病、遗传代谢性肝病,以及重症感染、休克、心功能不全等引起的肝损伤。以往采用“排除法(exclusion)”表述,即需要排除其他肝损伤病因才能进一步确认是中草药或其他药物引起的肝损伤 [1-2,18]。然而,在真实世界临床实践中,许多患者存在慢性乙型肝炎、慢性丙型肝炎、脂肪性肝病、肝硬化等基础肝病,且这些肝病本身可能即为活动性,但不能因为这些肝病的存在而否定 HILI 或 DILI 存在。这种情况下,其他肝损伤病因是无法被“排除”的,而是需要通过“排查”,包括“筛查(screening)”和“鉴别(distinguishment)”来判断这些肝病是静止性的、活动性的还是与中草药共同构成肝损伤的病因,为此需要综合分析病史、症状体征、实验室检查、影像检查乃至肝活检等资料。
4.1
病史、症状和体征
应详细了解患者既往有无肝炎病毒感染、饮酒(包括饮用药酒)、脂肪肝、遗传代谢性肝病等病史,以及可影响肝脏的肝外组织器官疾病史。乏力、食欲减退、腹胀、皮疹、皮肤瘙痒、黄疸、大便色浅、肝性脑病、腹水、瘀点瘀斑、出血等肝病相关表现对于肝损伤的病因判断不具有特异性,但有助于判断肝损伤的严重程度。皮肤瘙痒和大便色浅还有助于判断是否存在胆汁淤积等。皮疹和外周血嗜酸性粒细胞增高(>5%)常提示存在变态反应,结合中草药应用史,进而提示可能存在中草药相关免疫介导的肝损伤。
4.2
实验室检查
ALT、AST、ALP、GGT、总胆红素(TBil)、白蛋白、凝血功能异常(PTA 降低或 INR ≥ 1.5)可反映肝损伤的类型和程度(1~5 级),但并不具有中草药等病因特异性 [1-2]。基于血清 ALT 和 ALP 水平计算的 R 值,或基于血清 AST 和 ALP 水平计算的新 R值(nR,适用于血清 ALT 值未知或已经使用降酶药物导致 ALT 明显低于 AST 的情况)有助于判断常见肝损伤的类型及其演变,即肝细胞损伤型(R 或nR ≥ 5)、胆汁淤积型(R 或 nR ≤ 2)或混合型(2< R 或 nR< 5)[22]。目前可用的药物(包括中草药)
特异性生物标志物十分缺乏;虽然检测吡咯双烷-蛋白加合物等有助于土三七所致肝窦阻塞综合征(HSOS)的诊断 [23-24],但其在临床上难以常规检测 [2,25]。血清 miRNA-122 等新型生物标志物虽然能够更敏感地反映肝损伤的存在,但并不具有药物和中草药特异性 [25-26]。需根据具体情况筛查抗 HAV、抗 HEV/HEV RNA、HBsAg/ 抗 HBc/HBV DNA、抗 HCV/HCV RNA、HDV-Ag/ 抗 -HDV/HDV RNA(当 HBsAg阳性时)、抗CMV/CMV DNA、抗 EBV/EBV DNA、抗 HSV 等各类病毒性标志物,免疫球蛋白、自身免疫性肝病抗体,以及铜蓝蛋白、血清铜和 24 h 尿铜等Wilson 病相关指标,甚或需进行遗传代谢性肝病相关基因检测 [2,18-19,26]。必要时亦需通过检测血常规、降钙素原(PCT)、急性期反应蛋白(CRP)、肝素结合蛋白(HBP)、B 型尿钠肽(BNP)、甲状腺相关指标等以了解是否存在感染、全身炎症反应、贫血、心血管功能不全及代谢相关性疾病等。
4.3
影像检查
通过腹部超声、计算机断层扫描(CT)或磁共振成像(MRI)等检查可了解有无胆道梗阻、原发性硬化性胆管炎(PSC)、肝硬化、肝占位、门静脉高压、脾脏肿大等情况。这些检查可为药物性胆汁淤积、慢性HILI、慢性肝病基础等提供鉴别诊断线索。CT 或 MRI影像上的“地图样改变”往往提示可能存在 HSOS[27]。
4.4
肝脏穿刺活检病理组织学检查
与大多数 DILI 病例相似,HILI 的病理组织学改变多不具有明确特征性 [1-2]。但某些病理组织学改变提示 DILI 可能,例如肝组织有嗜酸性粒细胞浸润,在除外寄生虫感染和嗜酸性肉芽肿后,对 DILI(包括 HILI)具有相对的特异性 [28-29];肝组织中有铁沉积,需考虑到含铁药物(包括中草药)引起肝损伤的可能性 [29-31]。某些病理改变甚至可指向某种具体中草药引起的肝损伤,例如以肝血窦损伤为主的病理改变可能提示土三七等疫情的 HSOS[1,27]。另有
一些病理组织学特征有助于确认其他肝病的存在,从而降低对 HILI 的因果等级评分,例如界面炎、玫瑰花结样肝细胞、淋巴细胞穿越、浆细胞浸润等提示自身免疫性肝炎可能性大 [32]。胡锡琪教授提出的“DILI 病理组织学评分系统(DILI-PSS)”是一种半定量病理评分系统,有助于更全面地集成各种病理组织学信息,对通过病理学评估药物 / 中草药与肝损伤的相关性具有较大参考价值 [28-29]。
5
梳理和构建支持 HILI 诊断的证据链并形成因果关系评估结果
通过细致而尽可能准确地采集上述系列信息,可以形成关于 HILI 诊断的完整证据链,进而通过相关的评分量表和 / 或结构化的专家观点评估程序,对中草药与肝损伤之间的因果关联程度进行评估。
5.1
量表评估法
5.1.1 RUCAM 量表和 RECAM 量表对 HILI 诊断的适用性 量表法适用于临床表型为肝细胞损伤型、胆汁淤积型或肝细胞损伤 / 胆汁淤积混合型 DILI/HILI病例的评估,而 HSOS、脂肪肝或其他特殊表型的HILI,目前尚无合适的评估量表可供使用。评估量表有多种,无论是西药还是中草药引起的肝损伤,都可以使用目前最常用的 RUCAM 评 估量表进行评估 [1-2,6-7,33-34]。新近部分欧美学者基于美国 DILIN网络和西班牙注册研究的前瞻性小样本数据库,提出了对 RUCAM 的电子化改良版本,即 RECAM[8]。国内由北京友谊医院、地坛医院、上海瑞金医院、海军军医大学 905 医院、东部战区总医院 5 家医院的多中心回顾性研究显示,RECAM 也可用于对 HILI因果关系的评估(数据待发表)。但在真实世界中,RECAM 对 DILI/HILI 的诊断价值如何,尚待多中心大样本前瞻性临床验证 [35-36]。
5.1.2 HILI 相关发病危险因素是否应当纳入 HILI 因果关系评估量表的证据链 HILI 发病危险因素复杂,涉及3 大类因素,即中草药相关因素、宿主因素和环境因素。这些危险因素对于 HILI 因果关系评分的价值各不相同。从逻辑上看,药物 / 中草药的肝毒性等危险因素是导致 HILI 的必要条件而非充分条件;而宿主和环境因素既非 HILI 发生的必然条件、更不是充分条件,且不确定性较大,因此新推出的 RECAM 量表不再将 RUCAM 量表中的年龄、妊娠、饮酒等“危险因素”列入证据链 [8]。
中草药相关危险因素。在符合时序逻辑和厘清其他肝损伤病因的情况下,药物相关危险因素对判断 HILI 的可能性有较大参考价值。如上所述,若中草药或其组分既往有引起肝毒性的报告,则为增加HILI 评估分值的重要因素。若存在“君臣佐使”不合理,日剂量大,疗程长,种植和炮制过程不规范或有污染,更支持中草药可能导致肝损伤的判断。
宿主相关危险因素。宿主因素有助于阐明 HILI 的发病机制,警示哪些人群更易于发生 HILI 和更应当注意防范 HILI 风险 [37],但从内在因果关系看,不论是宿主遗传因素还是非遗传因素,其实均不能成为肯定或否定 HILI 的证据。宿主非遗传性因素如年龄、性别、妊娠等可能与 HILI 的发生风险相关 [37-40],但这种相关性总体上并不稳定或明确,争议较大 [18-19];各类慢性肝病对 HILI 发生风险的不良影响相对得到公认,但与 HILI 并不存在必然的因果关联。宿主遗传因素涉及药物 I 相代谢酶(如细胞色素 P450 系统)、II 相代谢酶(如 N- 乙酰基转移 2、谷胱甘肽 S 转移酶、尿苷葡萄糖醛酸转移酶等)、药物转入或转出系统(包括各种转运蛋白和多肽)的基因多态性 [17,38],以及人类白细胞抗原系统(HLA)等位基因的多态性等 [17]。小样本研究提示,何首乌相关 HILI 患者群体HLA-B *35:01 等位基因概率约为 41%(对照组仅为11.9%)[9],美国绿茶相关肝损伤群体 HLA-B *35:01等位基因概率约为 72%(对照组为 12%~15%),中国人群 HLA-A*02:01 与丹参酮所致 HILI 相关 [41]。但这些遗传特征并不能作为确认某种中草药肝损伤的特异性因素。
环境相关危险因素。环境危险因素通常是指饮酒、吸烟、食品中化学毒素或生物毒素污染、染发染甲、房屋装修污染、工业生产场所有毒化学品污染等。由于环境中的这些毒素可能会引起毒物性肝损伤(toxicant-induced liver injury,TILI),因此实际上应当是因果关系评估的减分因素。而 RUCAM 量表将饮酒作为因果关系评估的加分因素 [6-7],且与鉴别诊断中需要排除的酒精性肝病(减分因素)形成对立的矛盾,这是 RUCAM 量表逻辑设计上的一个缺陷。即使不考虑将这些环境因素作为减分因素,至少也不应当将其列为加分因素。因此 RECAM 量表不再将宿主和环境危险因素列为 DILI 评分的参数 [8]。
5.2
结构化专家观点评估程序(SEOP)
SEOP 是 美 国 药 物 性 肝 损 伤 网 前 瞻 性 研 究(DILIN-PS)对入组病例采用的因果关系评估法,适用于所有类型 DILI/HILI 因果关系的评估 [42]。当肝损伤不属于上述常见的肝细胞损伤型、胆汁淤积型或混合型,而是呈现为 HSOS、肝脂肪变性、肝肉芽肿、肝硬化等其他表型,或应用抗炎保肝利胆药物使得 RUCAM 和 RECAM 量表的适用性均受限时,仍可应用 SEOP 对 DILI/HILI 进行因果关系评估。
不论是 RUCAM 还是 SEOP,均存在一定概率的观察者内部和观察者之间评估差异。比较研究显示,RUCAM 更倾向于得出相对较弱的因果关系,而SEOP 更倾向于得出相对较强的因果关系 [42]。小样本前瞻性研究初步评价认为,总体上 RECAM 的评估效能与 RUCAM 相当,但更倾向于得出较高的评分 [8],这与 SEOP 更接近。
美国胃肠病学会的特异质性肝损伤实践指南将SEOP 称为诊断 DILI/HILI 的金标准 [19],但因 SEOP鲜明的主观特性,许多专家并不认可这种“金标准”提法;且 SEOP 程序过于复杂,因而在临床上极少应用。真实临床中通常采用简化的专家观点判断法,结合RUCAM 量表评分结果,对 DILI/HILI 进行诊断分析。RUCAM、RECAM 和 SEOP 对 DILI/HILI 因果关联等级比较见表 1。

评估 HILI 的严重程度
6
对 HILI 严重程度进行评估有助于对患者采取个性化的救治策略。建议参考《药物性肝损伤诊治指南》(2015 版)[1] 和《中草药相关肝损伤临床诊疗指南》(2016 版)[2] 对 HILI 的严重程度进行评估。
7
HILI 的诊断路线图及完整诊断
根据以上分析,HILI 诊断路线可参考如下流程(图 1)。完整的 HILI 诊断应包括以下 6 个要素:①主要诊断:药物性肝损伤(某中草药相关);②西医分型:肝细胞损伤型、胆汁淤积型、混合型、肝窦阻塞综合征、急性脂肪肝等;③中医分型:中医病历需注明湿热黄疸、肝郁脾虚、寒湿瘀阻、气滞血瘀、肝肾阴虚等证型 [2];④发病缓急:急性、慢性;⑤严重程度:对照指南推荐的严重程度分级(1、2、3、4 <急性肝衰竭>、5 级)[1-2];⑥因果关系:评分方法(RUCAM或 RECAM 等)+ 分值 + 等级。完整的 HILI 诊断举例:药物性肝损伤(何首乌相关),肝细胞损伤型伴急性脂肪肝,湿热黄疸型,急性,严重程度 4 级(急性肝衰竭),RUCAM 6 分(很可能)。
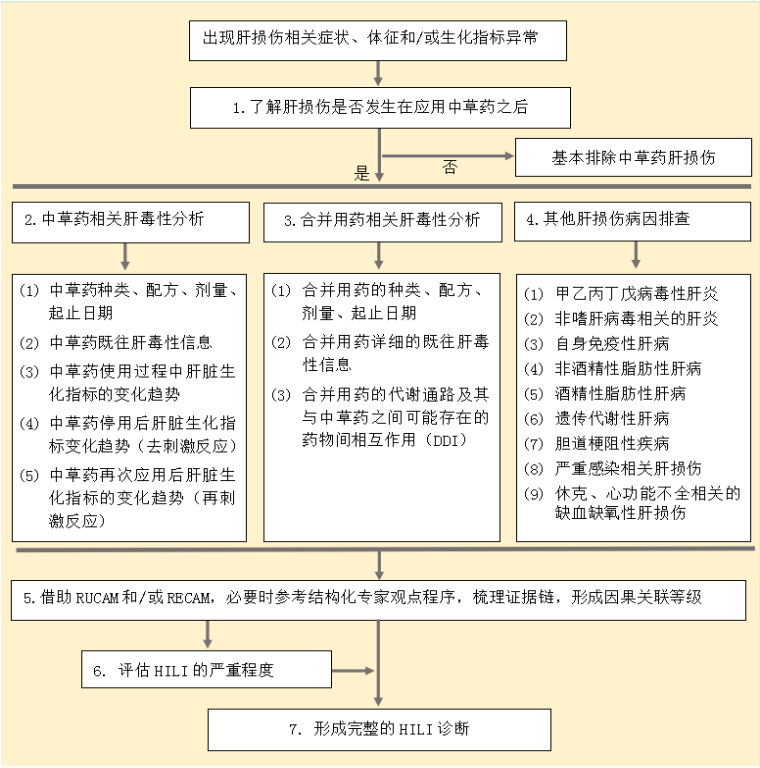
图 1 HILI 诊断路线图
Figure 1 Diagnostic roadmap for HILI
总结和展望
8
HILI 的临床诊断具有与现代药(化学药和生物药)相似的基本逻辑特点,但由于中草药的成分、配制方法、炮制方法和属地差异,缺乏像现代药那样的严格监管,且许多民众误认为中草药(包括含中草药的保健品或茶类等)安全无毒,难以提供详细且准确的用药史,因此中药草肝损伤的诊断又具有自身的特点和难点 [3,27]。在确认应用中草药与肝损伤之间存在符合逻辑的时序关系后,通过详细考察 3 大模块信息,即中草药自身相关的各类肝毒性信息、合并用药情况和是否存在其他肝损伤病因,多数情况下不难获得较为明确的诊断。RUCAM 评分结果对 HILI 的诊断有参考价值,RECAM 对 HILI 的诊断价值有待多中心临床研究论证。在 RUCAM 和 / 或 RECAM 评分不确定的情况下,可参考 SEOP 讨论确定诊断。在充分获取临床信息的情况下,肝活检病理组织学的某些改变对 HILI 的诊断具有重要价值。通过代谢组学等先进的研究手段探讨中草药特异性生物标志物,是未来改进和完善 HILI 诊断证据链的重要方向之一 [3]。
参考文献
[1] YU YC, MAO YM, CHEN CW, et al.DILI study group, Chinese socity of hepatology. Csh guideline for the diagnosis and treatment of drug-induced liver injury[J]. Hepatol Int, 2017, 11(3): 221-241.
[2] WANG JB, ZHU Y, BAI ZF, et al.Guidelines for the diagnosis and management of herb-induced liver injury[J]. Chin J Integr Med, 2018, 24(9): 696-706.
[3] YU YC, FAN Y, CHEN CW.Research status and prospect of liver injury related to herbal and dietary supplements[J]. Chin Heptol(肝脏), 2017, 22(4): 296-300.
[4] HOOFNAGLE JH, SERRANO J, KNOBEN JE, et al.LiverTox: a website on drug-induced liver injury[J]. Hepatology, 2013, 57(3): 873-874.
[5] MAO YM.HepaTox: a professional network platform to promote clinical and translational research of drug-induced liver injury in China[J]. Chin Heptol(肝脏), 2014, 19(8): 575-576.
[6] DANAN G, BENICHOU C.Causality assessment of adverse reactions to drugs I. A novel method based on the conclusions of international consensus meetings: application to drug induced liver injuries[J]. J Clin Epidemiol, 1993, 46(11): 1323-1330.
[7] DANAN G, TESCHKE R.RUCAM in drug and herb induced liver injury: the update[J]. Int J Mol Sci, 2015, 17(1): 14.
[8] HAYASHI PH, LUCENA MI, FONTANA RJ, et al.A revised electronic version of RUCAM for the diagnosis of DILI[J]. Hepatology, 2022, 76(1): 18-31.
[9] HUANG DL, LI CP, WANG JB, et al.Correlational verification of drug-induced liver injury with HLA-B*3501 allele due to polygonum mutiflorum[J]. Chin J Hepatol(中华肝脏病杂志), 2021, 29(11): 1106-1108.
[10] ZHAO WW, SHAN W, ZHANG SW, et al.Clinical analysis of 44 cases of liver injury induced by Tripterygium wilfordii[J]. Chin J Drug Abuse Prevention and Treatment(中国药物滥用防治杂志), 2018, 24(5): 268-271.
[11] PENG MM, GE WH, ZHUGE YZ.Clinical analysis on Gynura segetum induced hepatic veno-occlusive disease[J]. Chin J Clin Pharmacol, 2018, 34(8): 938-941.
[12] WANG L, WANG Y, WEE A, et al.Clinicopathological features of Bu Gu Zhi-induced liver injury, a long-term follow-up cohort study[J]. Liver Int, 2020, 40(3): 571-580.
[13] SHEN H, ZHANG ZY.Natural Drugs and Drug-induced Liver Injury(天然药物与药物性肝损伤)[M]. Nanjing: Southeast University Press, 2020: 201-240.
[14] WANG XL, GOU XJ, CHEN L, et al.Metabolomics of Gynura segetum-induced hepatotoxicity in rats[J]. Chin Traditional Patent Medicine, 2019, 41(8): 1826-1834.
[15] LI DD, TANG XL, LONG L, et al.Research of hepatotoxicity mechanism of crude Polygonum Multiflorum and Radix Polygonum Multiflorum Preparata based on high-content screening techniques. Chin J Pharmacol Toxicol(中国药理学与毒理学杂志), 2017, 31(6): 626-635.
[16] WANG XJ, CHEN CW, FU QC.Drug-induced liver injury related with zhixue capsules: an analysis of 30 gregarious patients[J]. Chin Hepatol(肝脏), 2009, 14(4): 287-290.
[17] YU YC, CHEN CW.Pathogenesis of drug-induced liver injury:current understanding and future needs[J]. J Clin Hepatol, 37(11): 2515-2524.
[18] European Association for the Study of the Liver. EASL clinical practice guidelines: drug-induced liver injury[J]. J Hepatol, 2019, 70: 1222-1261.
[19] CHALASANI NP, MADDUR H, RUSSO MW, et al.ACG clinical guideline: diagnosis and management of idiosyncratic drug-induced liver injury[J]. Am J Gastroenterol, 2021, 116(5): 878-898.
[20] YU YC, FAN Y, CHEN CW.Rechallenge test of drug induced liver injury: Can it be intentional? How to operate? How to judge?[J]. Chin Hepatol(肝脏), 2017, 22(12): 1073-1076.
[21] General Office of the National Health Commission, State Administration of Traditional Chinese Medicine Comprehensive Department. Diagnosis and Treatment Protocol for COVID-19 (Trial version 10)[EB/OL]. General Office of the National Health Commission, State Administration of Traditional Chinese Medicine Comprehensive Department. (2023-01-05)[2023-01-16]. http://www.nhc.gov.cn//xcs/zhengcwj/202301/8e6e038fe3ef4b5c9629e0293dd3dd19.shtml.
[22] LEISE MD, POTERUCHA JJ, TALWALKAR JA.Drug-induced liver injury[J]. Mayo Clin Proc, 2014, 89(1): 95-106.
[23] MA J, XIA Q, FU PP, et al.Pyrrole-protein adducts-a biomarker of pyrrolizidine alkaloid-induced hepatotoxicity[J]. J Food Drug Anal, 2018, 26(3): 965-972.
[24] WANG LL, SUN J.Progress in diagnosis and treatment of hepatic sinus obstruction syndrome caused by pyrrole alkaloids[J]. Int J Dig Dis(国际消化病杂志), 2020, 40(2): 96-99.
[25] YU YC, HE CL, HOU JL.Biomarkers in drug-induced liver injuries[J]. J Pract Hepatol(实用肝脏病杂志), 2014, 17(6): 564-568.
[26] Asia Pacific Association of Study of Liver. Drug-induced liver injury: Asia pacific association of study of liver consensus guidelines[J]. Hepatol Int, 2021, 15(2): 258-282.
[27] ZHUGE Y, LIU Y, XIE W, et al.Chinese society of gastroenterology committee of hepatobiliary disease. expert consensus on the clinical management of pyrrolizidine alkaloid-induced hepatic sinusoidal obstruction syndrome[J]. J Gastroenterol Hepatol(中华消化杂志), 2019, 34(4): 634-642.
[28] HU XQ.Discussion on pathological scoring system of drug-induced liver injury[J]. Chin J Hepatol(中华肝脏病杂志), 2012, 20(3): 176-177.
[29] HU XQ.Restudy on pathological scoring system of drug-induced liver injury[J]. Chin Hepatol(肝脏), 2014, 19(8): 577-579.
[30] LUO Q, ZHU HR, GU HT, et al.Liver histopathological features of patients with drug-induced liver injury due to chinese herbal medicine and western medicine: a comparative analysis of 50 cases[J]. J Clin Hepatol(临床肝胆病杂志), 2020, 36(3): 596-601.
[31] JIANG ZL, LI PING, WANG JL, et al.Relationship between liver tissue iron deposition and serum biochemistry and pathology in 106 patients wiht drug-induced liver injury[J]. Chin J Dig(中华消化杂志), 2016, 36(8): 543-547.
[32] YANG RY, ZHAO XY.Significance of liver histopathological examination in diagnosis and treatment of drug-induced liver injury[J]. J Chin Hepatol(临床肝胆病杂志), 2018, 34(6): 1172-1175.
[33] SOARES PF, FERNANDES MTCF, SOUZA ADS, et al.Causality imputation between herbal products and HILI: an algorithm evaluation in a systematic review[J]. Ann Hepatol, 2021, 25: 100539.
[34] DANAN G, TESCHKE R.Drug-induced liver injury: why is the roussel uclaf causality assessment method (RUCAM) still used 25 years after its launch?[J]. Drug Saf, 2018, 41(8): 735-743.
[35] LEWIS JH.Digitizing DILI: Who can? RUCAM? RECAM?[J]. Hepatology, 2022, 76(1): 3-5.
[36] DANAN G, TESCHKE R.Letter to the editor: electronic RUCAM: major pitfalls call for caution and proper validation[J]. Hepatology, 2022, 76(1): E27.
[37] BESSONE F, ROBLES-DIAZ M, HERNANDEZ N, et al.Assessment of serious acute and chronic idiosyncratic drug-induced liver injury in clinical practice[J]. Semin Liver Dis, 2019, 39(3): 381-394.
[38] HOU FQ, ZENG Z, WANG GQ.Hospital admissions for drug-induced liver injury: clinical features, therapy, and outcomes[J]. Cell Biochem Biophys, 2012, 64(2): 77-83.
[39] MARTINEZ MA, VUPPALANCHI R, FONTANA RJ, et al.Clinical and histologic features of azithromycin-induced liver injury[J]. Clin Gastroenterol Hepatol, 2015, 13(2): 369-376.
[40] LIN NH, YANG HW, SU YJ, et al.Herb induced liver injury after using herbal medicine: a systemic review and case-control study[J]. Medicine (Baltimore), 2019, 98(13): e14992.
[41] ZHU Q, ZHANG Y, XUAN J, et al.HLA-A*02:01 allele is associated with transhinone-induced cutancous adverse drug reactions[J]. Pharmacogenomics, 2019, 20(3): 408-414.
[42] ROCKEY DC, SEEFF LB, ROCHON J, et al.Causality assessment in drug-induced liver injury using a structured expert opinion process: comparison to the roussel-uclaf causality assessment method[J]. Hepatology, 2010, 51(6): 2117-2126.

