声明:因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及);本文不构成任何投资建议。
作为生物医药领域的“明星赛道”,小核酸技术凭借在疾病治疗中的独特优势,近年来持续成为资本与产业的双重焦点。2025年,这一赛道的融资热潮更是贯穿全年,热度居高不下。而年末压轴时刻,12月31日,瑞博生物顺利完成1亿美元基石轮融资。这笔跨年融资,为2025年小核酸领域的投融资盛宴,画上了圆满且有力的句号。
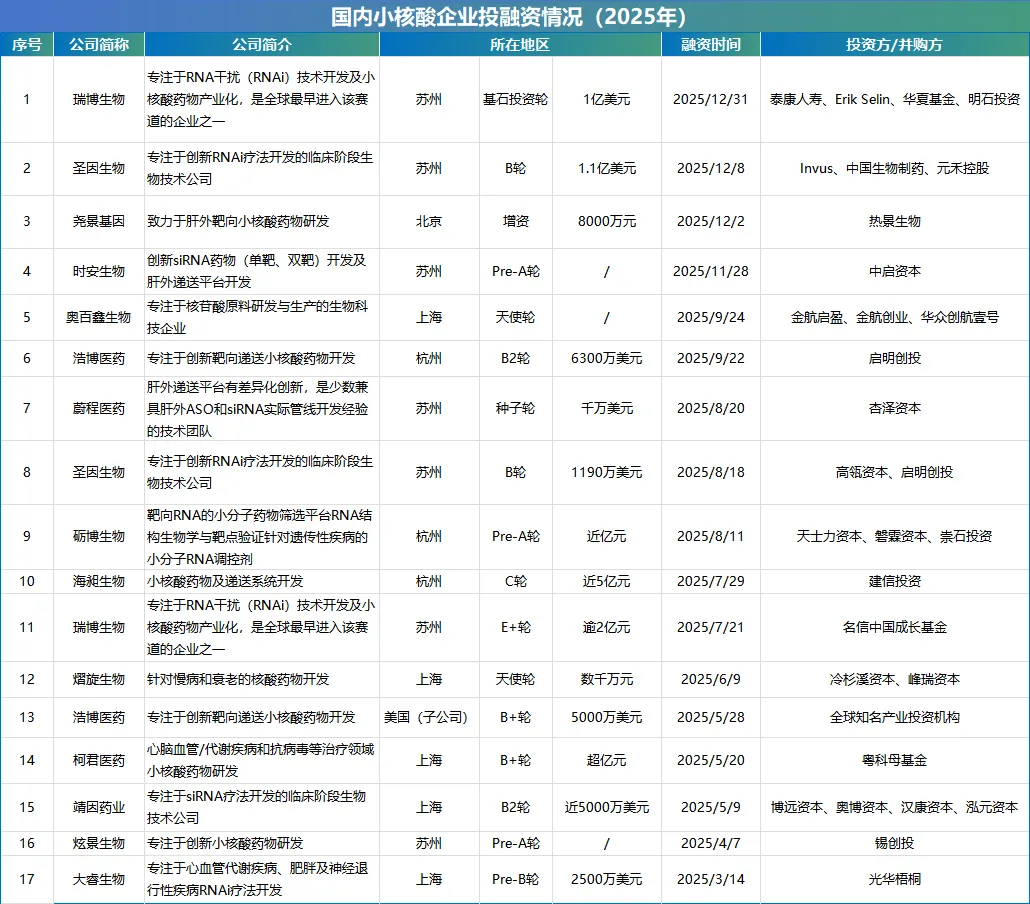
不完全统计,2025年国内小核酸领域共披露17起投融资事件。明确披露的融资金额合计超30亿元,头部企业凭借技术壁垒与管线优势,稳稳主导着整体融资格局。值得关注的是,行业在地域集聚、技术突破、赛道布局上,已清晰呈现三大核心趋势。曾经的“潜力赛道”,如今正式迈入高质量发展的全新阶段。

资料来源:摩熵医药数据库
从整体来看,2025年小核酸赛道融资呈现“全周期覆盖+大额资金扎堆”
企业在技术路线选择与管线布局方向上各有专攻。融资轮次贯穿种子轮到E轮的完整周期,既展现了资本对行业全成长阶段的覆盖力度,也印证了部分企业已迈入发展相对成熟的后期阶段。
从细节来看2025年小核酸领域的融资,呈现出三大鲜明特点
融资企业里,苏州、上海、杭州三地合计占比76.5%。长三角依托完善的产业链、丰富的研发资源与成熟的资本生态,成为小核酸产业的集聚高地。北京作为北方重镇,以尧景基因为代表的企业形成产业补充,地域集中度的提升,更凸显出产业生态对领域发展的关键作用。

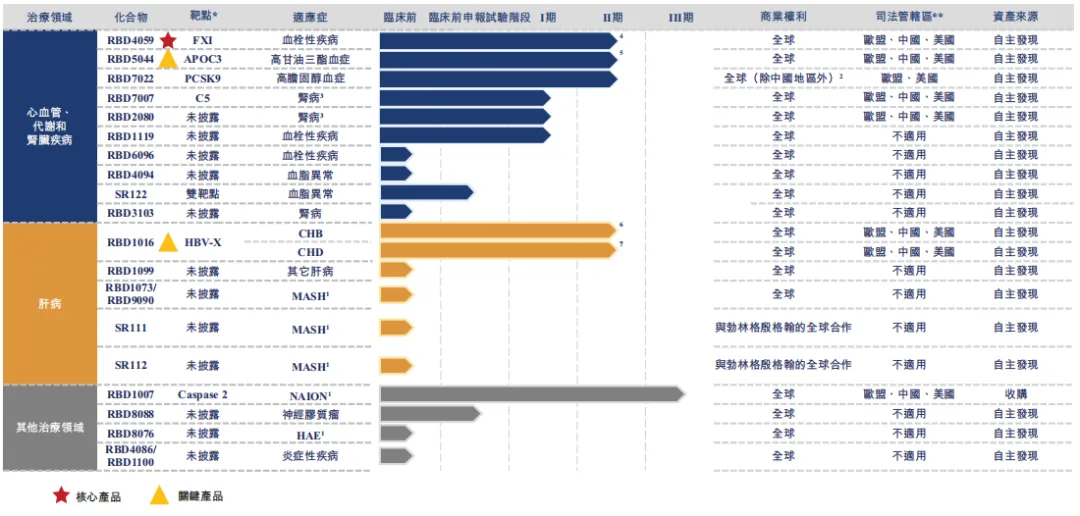
公司以自主创新的小核酸技术平台为引擎,围绕心血管代谢、肝脏、肾脏等重大疾病领域布局了丰富且差异化的产品管线,有七款自研药物资产处于临床试验阶段,涉及心血管、代谢类、肾脏和肝脏疾病的七种适应症,其中四款处于2期临床试验中。核心产品RBD4059(靶向FXI的 siRNA)是全球首款、也是临床开发进展最快的用于治疗血栓性疾病的siRNA药物。除核心产品RBD4059外,公司正在推进两款关键产品RBD5044及RBD1016。RBD5044是全球第二个进入临床开发的靶向APOC3的siRNA。APOC3是一种在脂质代谢中起关键作用的蛋白质。RBD1016凭藉其对HBsAg的强效和持久作用,是未来实现慢性乙型肝炎(CHB)功能性治愈的联合方法的重要支柱疗法,同时也是治疗冠心病(CHD)的领先siRNA候选药物。除临床产品管线之外,有超过20个计划推进到临床开发阶段的临床前项目。
资料来源:瑞博生物招股书

圣因生物成立于2021年,是一家聚焦RNAi疗法开发的全球一体化临床阶段生物技术公司,依托具有自主知识产权的GalNAc肝脏递送平台和行业领先的LEAD™肝外递送平台,致力于解决肥胖症、心血管代谢疾病和免疫介导性疾病领域等重大未满足的临床需求。
LEAD™平台能够高效地将siRNA特异性递送至脂肪、肌肉、免疫细胞及中枢神经系统等肝外组织,实现对致病基因高效、安全且持久的沉默,并大幅降低给药频率。2025年11月礼来就看上了该LEAD™肝外递送平台,与圣因生物达成合作,圣因生物筛选RNAi活性分子,礼来负责临床、商业化,圣因有权收取后续高达12亿美元里程碑。作为2021年才成立的公司,圣因能迅速搭建LEAD™肝外递送平台,跟其创始人王为民、王师钰均来自Dicerna不无关系(海外siRNA小龙头,其GalXC-Plus™递送平台涵盖了CNS、肌肉等肝外递送,已被诺和诺德33亿美元收购)。
2025年圣因生物两轮B轮融资累计超8.6亿元(1.1亿美元+1190万美元),吸引Invus、高瓴资本等中外资本加注。管线覆盖肥胖症、补体介导疾病等领域:肥胖症候选药SGB-7342(靶向INHBE)于2026年1月启动中国1期临床,临床前数据显示可强效减重并维持肌肉量;补体C3靶向药SGB-9768进入中国II期临床,I期数据显示单次给药后C3最大敲降达96.3%,获FDA孤儿药资格,具有同类最优潜力。

资料来源:圣因生物官网

浩博医药AusperBio成立于2019年,是一家在中国和美国同步运营的临床阶段创新药研发公司,核心团队来自Gilead、Sugen等国际顶尖药企,具备丰富的创新药研发与商业化经验,专注于开发具有First-in-class和Best-in-class潜力的自主创新靶向递送小核酸药物。公司拥有完全自主知识产权的Med-Oligo™ ASO 技术平台,核心聚焦于慢性乙型肝炎(HBV)的功能性治愈和肝脏疾病的高效靶向治疗,并积极拓展至肝脏以外的新靶点领域。其战略是将全球领先的Med-Oligo™寡核苷酸技术和特异高效的靶向递送平台相结合,推动一系列创新疗法的开发,从而解决目前未被满足的重大医疗需求。
浩博医药2025年融资超8.1亿元(6300万美元+5000万美元)。该新型非偶联ASO药物具有三重作用机制,IIa期数据显示,基线HBsAg 100-1000 IU/mL患者单药治疗24周,第72周临床治愈率达30%,停药后24周HBV DNA阴性率100%;目前已提前完成中国III期临床入组,同步推进海外II期试验。

海昶生物创立于2013年,其创始人是前FDA高级审评员赵孝斌,他有着丰富的FDA工作经历。他于2010年加入FDA,担任FDA药审中心(CDER)资深审评员,主要负责复杂药物的审批工作,重点审查多肽、脂质体等药物的CMC一致性评价以及cGMP质量系统。此外,他还参与了FDA的纳米药物法规指南协调工作组,参与制订了多项脂质体相关药物的申报指南。在他的带领下,海昶生物核心技术QTsome®脂质纳米颗粒递送平台,突破国际核酸递送专利壁垒。
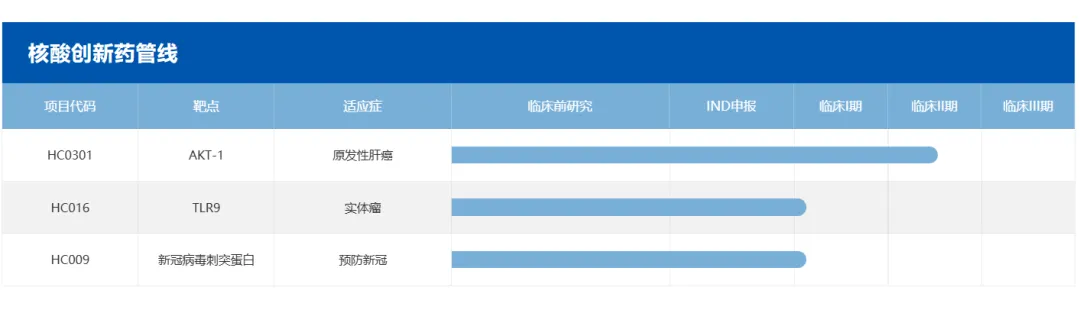
2025年获得近5亿元C轮融资,加码核酸创新药与高端复杂注射剂开发。海昶生物的研发管线广泛覆盖抗肿瘤、代谢病、镇痛、传染病等多个关键治疗领域。以抗肿瘤领域为例,针对原发性肝癌研发的小核酸创新药HC0301,海昶生物目前正在国内、中国香港以及美国同步开展多中心Ⅱ期临床试验,其研发进度在全球小核酸肿瘤精准治疗领域处于领先地位,具同类最佳潜质,公司已有商业化注射剂产品实现国际化营收。
资料来源:海昶生物

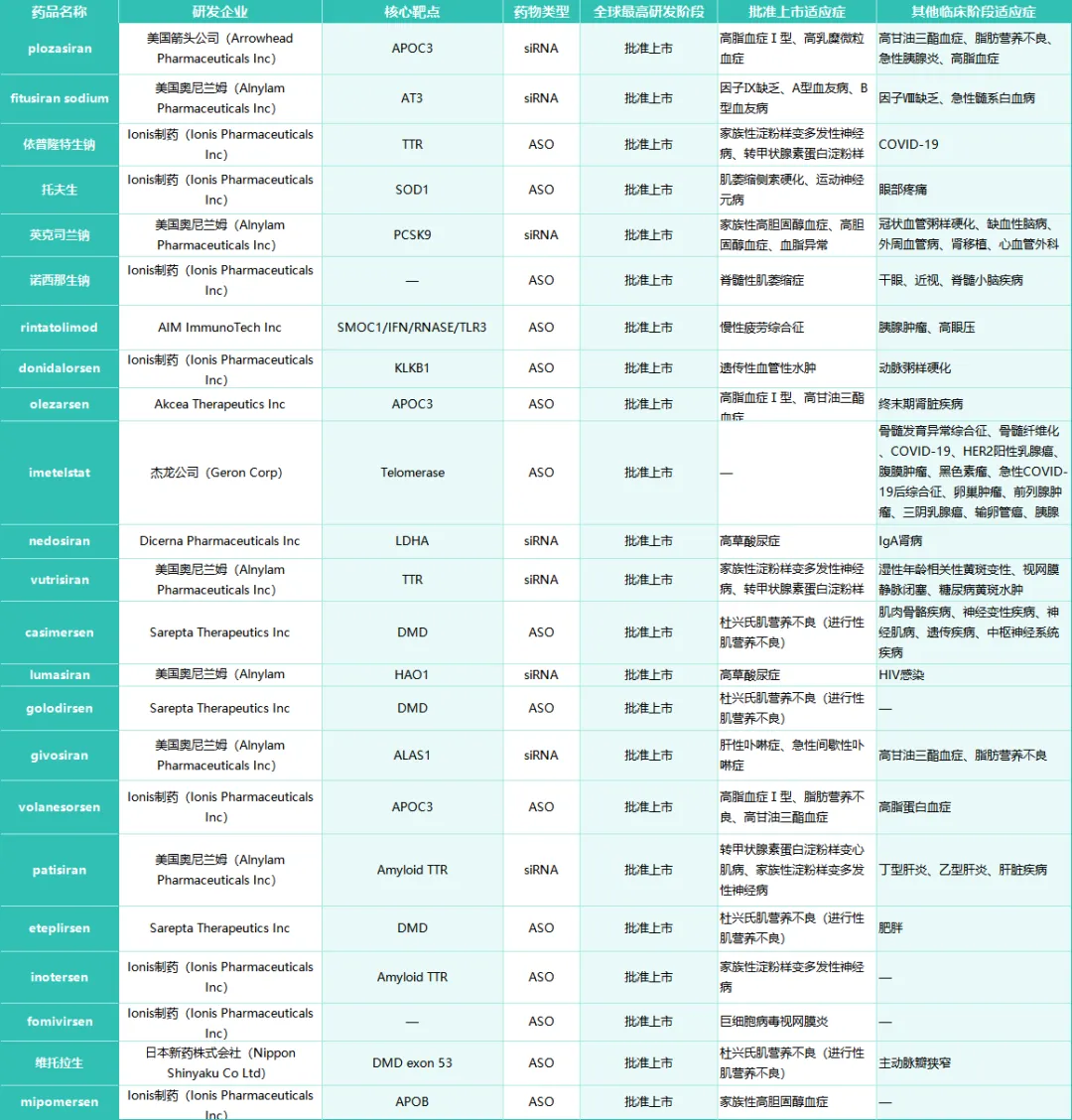
截至2026年1月,全球共获批上市23款:15款ASO药物、8款siRNA药物。其中遗传罕见病类目是获批最多的适应症类别。
资料来源:摩熵医药数据库
但目前为止,中国本土企业自主研发的小核酸药物尚未有获批上市的产品,目前国内获批上市的小核酸药物均为跨国药企原研,例如诺华的英克司兰钠、赛诺菲的普乐司兰钠等。
不过,国内多家企业的小核酸药物已进入临床后期阶段,距离上市仅一步之遥。浩博医药的核心产品AHB-137(乙肝功能性治愈ASO药物)已完成中国III期临床入组,若试验数据积极,有望成为国内首个自主研发并获批上市的小核酸药物,预计2027年左右获批。
市场规模的扩容脚步从未停歇。从2019年的27亿美元,稳步增长至2024年的57亿美元,16.2%的复合年增长率,清晰彰显出技术潜力与临床价值,已获得市场的初步验证。
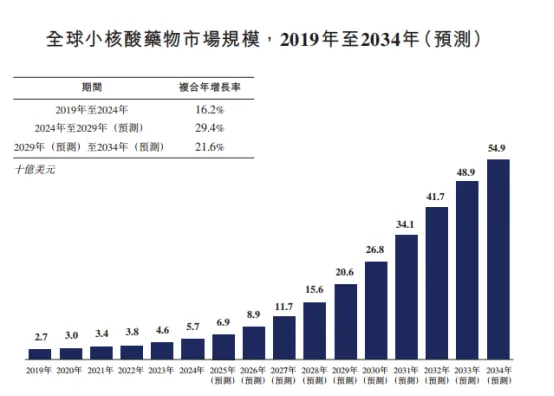
参考来源:弗若斯特沙利文报告
资本的热烈追捧,早已成为小核酸行业发展的重要风向标。2025年斩获的30亿元融资,不只是资本市场对技术成熟度的高度认可,更清晰折射出行业商业化落地的广阔前景。
技术突破尤其是递送系统的革新,正在为行业撬开更大成长空间。肝外递送等关键技术的持续迭代,不仅让小核酸药物的应用场景,从传统领域向更多疾病类型延伸,更在安全性与有效性上实现质的提升,为临床价值落地筑牢坚实基础。
但挑战与机遇向来共生。
高壁垒的研发环节,对企业的技术储备与资金实力提出严苛要求;行业竞争日趋激烈,也进一步加剧市场分化。而从临床研发到商业化落地的跨越,更是对企业渠道建设、支付准入、市场教育等综合能力的全面考验。
2026年,小核酸行业将正式步入“临床价值深度验证+商业化破冰攻坚”的关键阶段。洗牌在所难免,格局亟待重塑,这会是全年行业的主旋律。
在此背景下,唯有手握核心递送技术、构建差异化管线布局、具备全产业链整合能力的企业,方能在激烈竞争中站稳脚跟、脱颖而出。它们将持续推动小核酸疗法的技术革新与市场普及,最终让这一前沿疗法,真正走进更多患者的生活,带来治愈的希望。


