关于公开征求《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)修订稿(征求意见稿)》意见的通知
发布日期:20230710
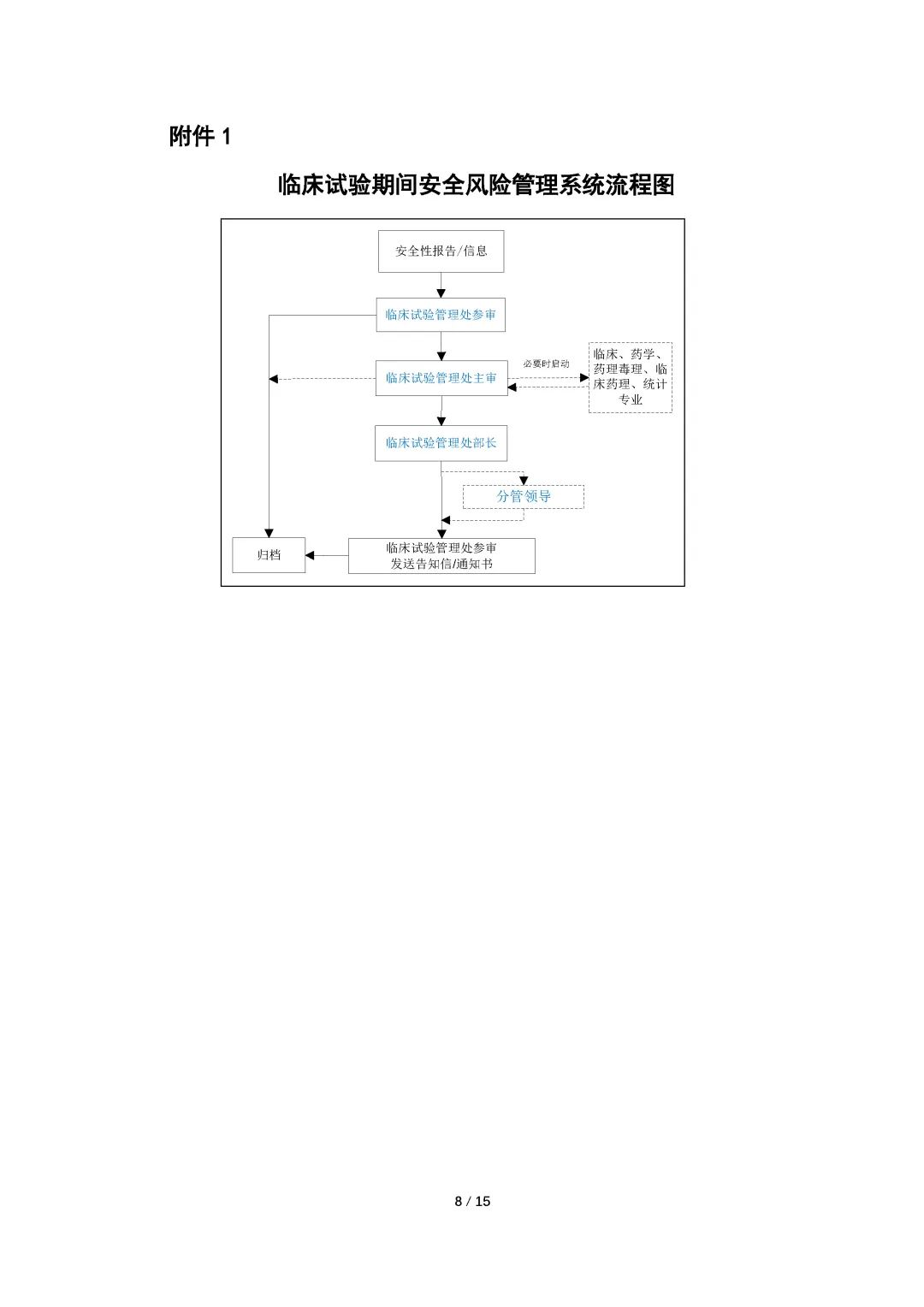
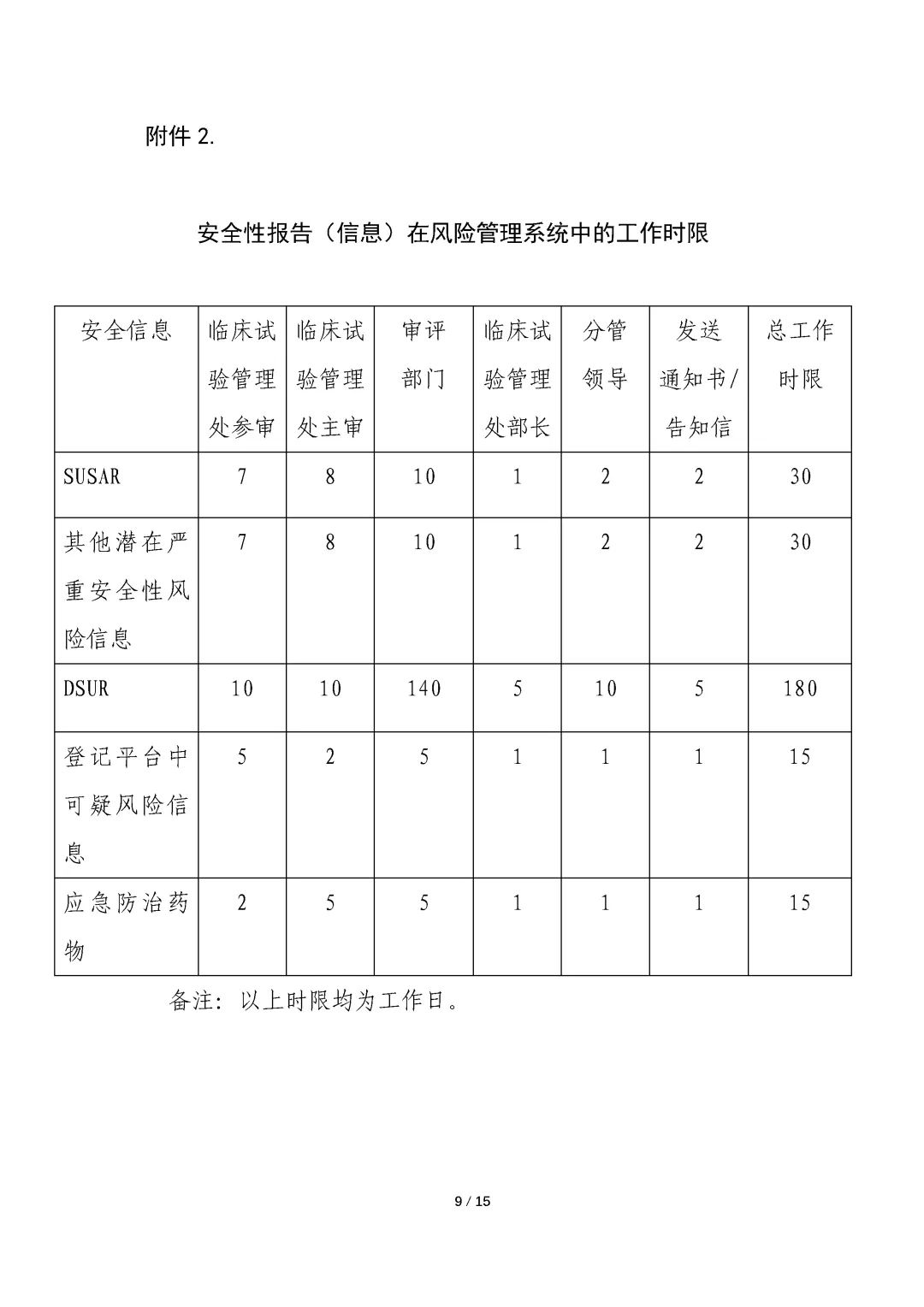
为规范药审中心临床试验期间安全信息评估与风险管理工作,2021年1月药审中心在内部发布实施了《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)》。基于近两年实施过程中任务启动与风险处理情况的汇总分析、NRA CT模块需完善的问题、以及重点问题的跨部门风险评估要求,我们对该内部工作程序进行了修订。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起2周。
您的反馈意见请发到以下联系人的邮箱:
联系人:刘文东,崔灿
联系方式:liuwd@cde.org.cn,cuic@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2023年7月10日
附件一
附件二


附件三

原文链接:https://www.cde.org.cn/main/news/viewInfoCommon/0f96d338437d28518128f940718b0925
国家药监局药审中心关于发布《临床试验中的药物性肝损伤识别、处理及评价指导原则》的通告(2023年第39号)
发布日期:20230710
为进一步规范和指导药物临床试验中药物性肝损伤风险的临床评价,提供可参考的技术规范,在国家药品监督管理局的部署下,药审中心组织制定了《临床试验中的药物性肝损伤识别、处理及评价指导原则》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:临床试验中的药物性肝损伤识别、处理及评价指导原则
国家药监局药审中心
2023年7月7日
附件

临床试验中的药物性肝损伤识别、处理及评价指导原则.pdf
扫码下载
原文链接:https://www.cde.org.cn/main/news/viewInfoCommon/c52487dac83ed5d20fe282d76c74e02d
转载:国家药品监督管理局药品审评中心 官网