前言/PREFACE
新版《医疗器械生产质量管理规范》共十五章132条,将于2026年11月1日起施行。整理一下,一起学习。未来几年,只有真正建立起科学、严谨、可持续的质量管理体系的企业,才能在激烈的市场竞争和严格的监管环境中脱颖而出。
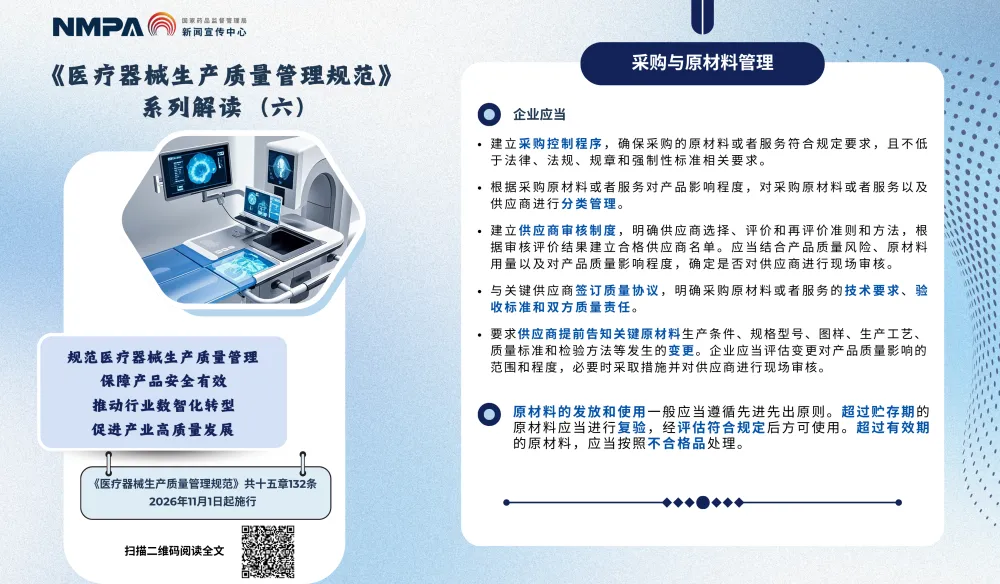
以上图片来源于国家药监局的系列解读六,聚焦于新版《医疗器械生产质量管理规范》中采购和原材料管理,核心目标是从源头控制产品质量风险,确保所用原材料安全、合规、可追溯。
采购和原材料管理
1.建立采购控制程序
➜ 要求:制定明确的采购流程,包括供应商选择、评估、审核、再评价等。
? 解读:
• 不能随便找一家供应商就下单;
• 需要建立《合格供应商名录》,定期评审;
• 对关键物料供应商,应进行现场审核。
? 示例:某人工关节企业对钛合金原料供应商,不仅查资质,还派人去工厂检查熔炼工艺和质控能力。
2.明确原材料质量标准
➜ 要求:所有原材料必须有清晰的质量标准,并在采购文件中写明。
? 解读:
• 标准可引用国标(GB)、行标、药典,或企业自定标准;
• 必须包含技术指标、检验方法、验收规则;
• 若使用药典标准,需注明具体版本(如《中国药典》2025年版)。
⚠️ 风险点:口头约定“差不多就行”,无书面标准,属于严重缺陷。
3.按标准检验或验证原材料
➜ 要求:每批原材料进厂后,必须按标准进行检验或验证。
? 解读:
• “批批检”是基本原则,尤其对关键物料;
• 可采用自检、委托第三方检测,或审核供应商COA(出厂检验报告)+抽样复检;
• 检验不合格的,不得用于生产。
? 实务:某IVD试剂企业对酶原料实行“双盲检验”——检验员不知道供应商是谁,避免主观偏差。
4. 建立原材料台账,实现全过程追溯
➜ 要求:记录原材料的采购、验收、贮存、使用情况,确保可追溯。
? 应配备的系统包括:
• 台账应包含:物料名称、批号、供应商、到货日期、检验结果、使用产品批次等;
• 使用UDI(唯一标识)或物料编码系统;
• 出现质量问题时,能快速定位影响范围(如召回哪些成品)。
? 工具建议:WMS系统自动关联原料批号与成品批号,一键追溯。
往期回顾:

你的点赞是我最大的动力

