SEND (Standard for Exchange of Nonclinical Data,非临床数据交换标准)是由CDISC (Clinical Data Interchange Standards Consortium,临床数据交换标准协会) 制定用于收集和呈现非临床数据的统一格式,也是FDA要求递交非临床数据的标准格式。

最新消息:2023年3月15日之后,SEND数据集强制递交了。
科临达康® Clindata®帮助创新药完成临床前SEND数据转换服务,成为中国本土少有的具有SEND转换能力,并能成功递交FDA的CRO。科临达康® Clindata®提供的价格是同行SEND转换价格是60%,给创新药企业节省了大量的成本。
科临达康中美双报团队可提供FDA SEND格式转换服务,服务咨询请联系:15001129703(微信同号)。
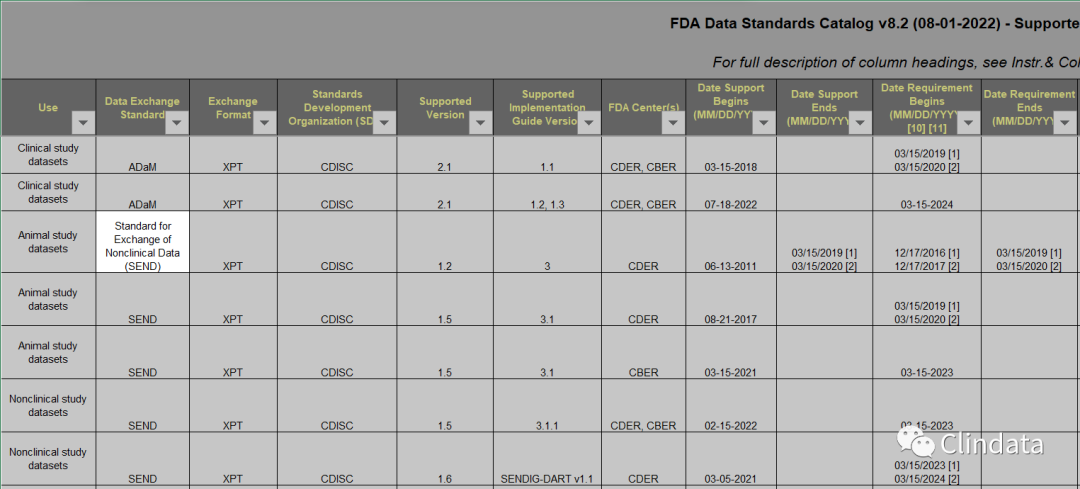



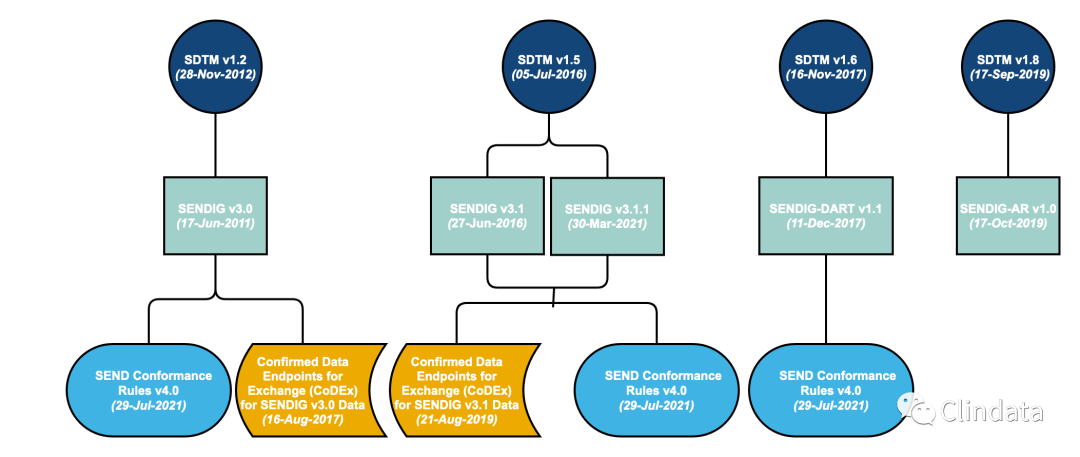


FDA CDER将从2021年9月15日起强制要求IND、NDA/BLA中需提交支持非临床试验的SEND Dataset,其中包括GLP和非GLP试验。如果SEND Dataset不能通过FDA验证,FDA将会拒绝受理该申请。

(1)申请人提交的IND申报资料中,以下非临床试验应提交SEND Dataset:
相关非临床试验开始时间 | FDA要求 |
A.试验开始时间早于(或在)2017年12月17日 | 申请文件需提交支持单次给药毒理学试验 (Single-dose toxicity study)、重复给药毒理学试验(Repeat-dose toxicity study)以及致癌性试验(Carcinogenicity study)的简化ts.xpt数据集(Simplified ts.xpt Dataset) |
B.试验开始时间晚于2017年12月17日 | 申请文件需提交支持单次给药毒理学试验、重复给药毒理学试验以及致癌性试验的SEND Dataset |
C.试验开始时间晚于2020年3月15日 | 除了需要满足上述B的要求,申请文件还需提交支持单独的心血管和呼吸安全药理学试验或者在重复给药毒理学试验期间收集的对心血管与呼吸系统测试结果的SEND Dataset |
(2)申请人提交的NDA/BLA申报资料中,以下非临床试验应提交其支持的SEND Dataset:
相关非临床试验开始时间 | FDA要求 |
A.试验开始时间早于(或在)2016年12月17日 | 申请文件需提交支持单次给药毒理学试验、重复给药毒理学试验以及致癌性试验的Simplified ts.xpt Dataset |
B.试验时间晚于2016年12月17日 | 申请文件需提交支持单次给药毒理学试验、重复给药毒理学试验以及致癌性试验的SEND Dataset |
C.试验时间晚于2019年3月15日 | 除了需要满足上述B的要求,申请文件还需提交支持单独的心血管和呼吸安全药理学研究或者在重复给药毒理学试验期间收集的心血管和呼吸测试结果的SEND Dataset |



